Structure secondaire des protéines
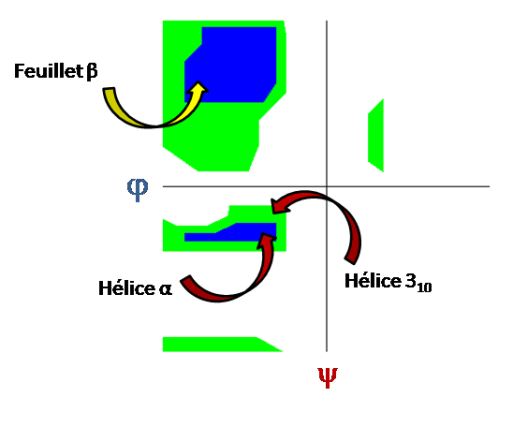
Pour des systèmes protéiques de grande taille, les interactions entre les acides aminés vont dicter la structuration du système. Les forces interatomiques et intermoléculaires vont mener à des structures caractéristiques que l'on peut décrire avec des critères basés sur les angles de Ramachandran (cf image). On parle de structure en hélice, en feuillet ou en coude par exemple. Ces structures sont majoritairement dictées par les liaisons hydrogène.
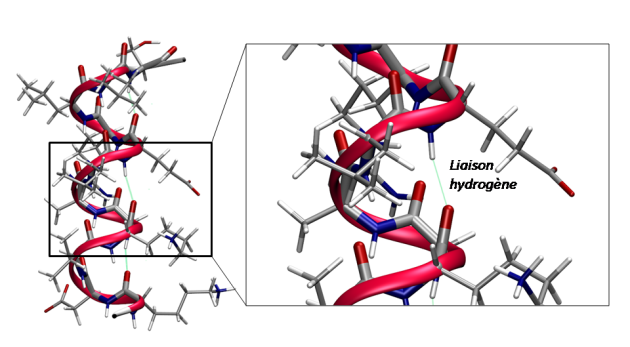
Définition : Hélices α
Les hélices dites α sont très répandues dans les structures des protéines. Elles sont des structurations périodiques de forme hélicoïdale. La forme est dictée par une interaction de type liaison hydrogène entre le groupement carbonyle d'un acide aminé et le groupement amide d'un autre acide aminé de la même chaine peptidique situé 4 résidus plus loin. Cette structure représente un îlot de stabilité sur les cartes de Ramachandran.
Exemple :
Video d'une hélice alpha au niveau atomique
Définition :
Hélices 310
La forme des hélices 310 est dictée par une interaction de type liaison hydrogène entre le groupement carbonyle d'un acide aminé et le groupement amide d'un autre acide aminé de la même chaine peptidique situé 3 résidus plus loin. C'est une structure plus rare que l'hélice α dans les protéines.
Définition :
Hélices π
La forme des hélices π est dictée par une interaction de type liaison hydrogène entre le groupement carbonyle d'un acide aminé et le groupement amide d'un autre acide aminé de la même chaine peptidique situé 5 résidus plus loin. C'est une structure très rare dans les protéines.
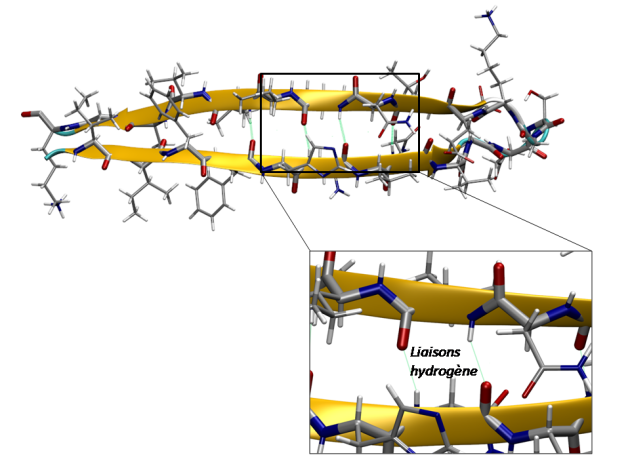
Définition : Brins β
les brins β sont des sous-structures dictées par des interactions de type liaison hydrogène. Elles ne sont pas stables seules, elles sont en revanche stabilisées lorsqu'elles s'assemblent pour former des feuillets. La structure en feuillet β représente un îlot de stabilité sur les cartes de Ramachandran.
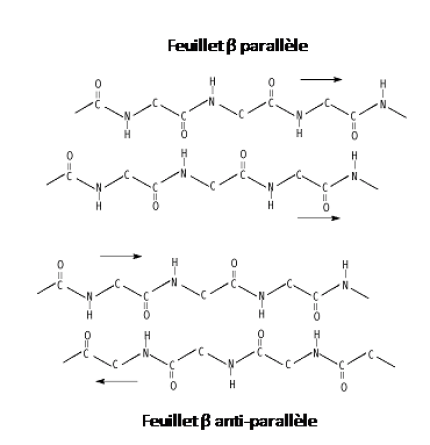
Définition : Feuillet β antiparallèle
Exemple :
Video d'un feuillet β antiparallèle au niveau atomique
Définition : Feuillet β parallèles
Cette structure est formée lorsque 2 brins différents ou très éloignés dans la séquence (plus de 20 résidus par exemple) sont parallèles l'un par rapport à l'autre et progressent dans la même sens. Alors, des liaisons de type hydrogène entre les groupements amide et carboxyle de chaque brin sont engagées.
Définition : Coudes
Les coudes sont des parties de structure plus complexes dans lesquelles ont peut trouver des transitions de structure ou la partie externe d'un feuillet β. Ils ont tendance à couder localement la structure de la protéine.
Définition : Parties non structurées
Il s'agit de structures de protéines qui n'ont pas de structure secondaire particulière. Ces parties sont très mobiles et flexibles, elles n'engagent pas d'interaction particulière entre les acides aminés qui la composent.