Structure tertiaire des protéines
A. Repliement d'une protéine, forces de cohésion
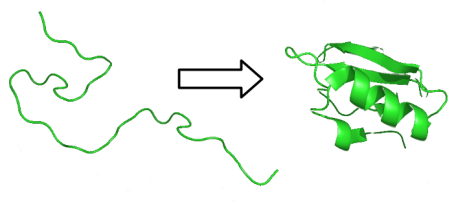
Les structures secondaires de type hélice α ou feuillet β confèrent un caractère étiré à la protéine. Cependant il existe des protéines sous forme globulaire ce qui nécessite le repliement de la chaîne peptidique sur elle-même. Ceci peut se réaliser grâce aux parties non (ou peu) structurées de la protéine et grâce aux différentes forces de cohésion (Cf. partie B) qui vont maintenir la conformation spatiale résultante de ce repliement.
Définition :
La structure tertiaire d'une protéine correspond au repliement de la chaîne polypeptidique en trois dimensions
La structure tridimensionnelle d'une protéine est maintenue par différentes forces de cohésion:
• les interactions covalentes comme les ponts disulfures entre les atomes de souffre des résidus cystéines
• les interactions électrostatiques comme les liaisons ioniques (par exemple entre la chaine latérale de l'arginine et de l'aspartate) ou les interactions de type "liaison hydrogène"
• les interactions de van der Waals
• les interactions avec l'environnement de la protéine (solvant, ions, lipides, ...)
Pour plus de détails cf. lien web
B. Structure native, Paradoxe de Levinthal
Structure native, Paradoxe de Levinthal
Définition : L'état natif d'une protéine
En biologie, l'état natif d'une protéine correspond à la structure fonctionnelle (ou opérationnelle) de celle-ci. Il est généralement admis que la structure native de la protéine est thermodynamiquement la plus stable.
Définition : Le paradoxe de Levinthal
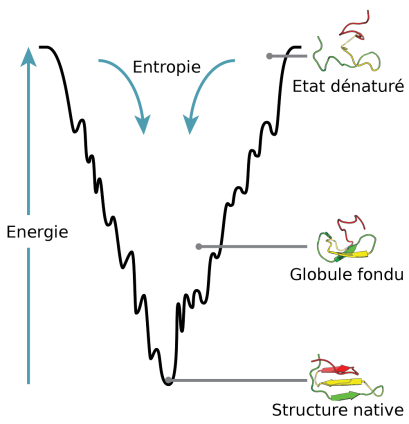
Le paradoxe de Levinthal est une réflexion sur la dynamique de repliement des protéines. Cyrus Levinthal fait remarquer en 1969 à la communauté scientifique qu'en raison du très grand nombre de degrés de libertés dans la chaîne polypeptidique, une protéine possède une quasi infinité de conformations possibles. Si la protéine doit échantillonner (tester, ou passer par des états) de manière séquentielle toutes les conformations possibles pour atteindre l'état natif, cela nécessiterait un temps plus grand que l'âge de l'univers même si les transitions entres conformations se font en un temps très court (de l'ordre de la nanoseconde ou de la picoseconde !).
La conclusion à cette réflexion est qu'il existe un chemin d'énergie privilégiée au repliement des protéines pour passer d'un état dénaturé à un état partiellement replié également appelé "globule fondu" pour enfin atteindre l'état natif. La recherche au hasard de la bonne conformation n'est pas privilégiée ! On peut citer aussi les protéines chaperones qui vont assister d'autres protéines à se structurer.
A l'inverse, la zone de stabilité des protéines dépend des conditions du milieu et la dénaturation (dépliement) d'une protéine peut être induite par différents facteurs :
• une modification des propriétés physiques du milieu (température, pression, champ électrique, ...)
• une modification du pH, de la force ionique ou de la constante diélectrique
• la présence d'agents dénaturant (urée, détergents, ...)
• la présence d'autres protéines
C. Topologie des protéines: Domaine, Motif
Les domaines sont des sous-ensembles structuraux et fonctionnels distincts dans la structure tertiaire d'une protéine.
Définition :
La structure tridimensionnelle des protéines est souvent modulaire. les domaines adoptent une conformation particulière, peuvent évoluer de façon indépendante du reste de la protéine et acquérir une fonction biologique particulière (fixation d'un ligand, ancrage membranaire, ...) . Une protéine composée de plusieurs domaines structuraux peut posséder plusieurs fonctions.
Exemple : Domaine
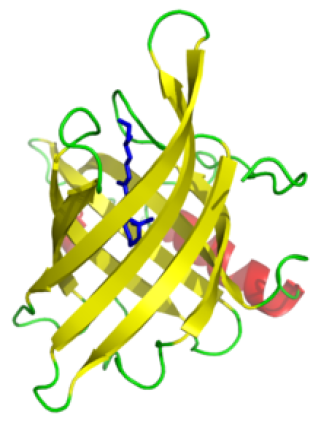
Un domaine en "tonneau béta" est une structure protéique constituée d'un grand nombre de feuillet β qui comme son nom l'indique rappelle la forme d'un tonneau. La figure représente une protéine de la famille des lipocalines: un représentant des domaines en tonneau β avec une structure en feuillet β à 8 brins (en jaune) et une hélice α (en rouge).
Définition :
Dans certains domaines, la présence d'acides aminés très conservés dans la séquence de la protéine (lorsque l'on compare plusieurs séquences de protéines similaires) caractérise des motifs structuraux aux fonctions particulières (cf video)
Exemple :
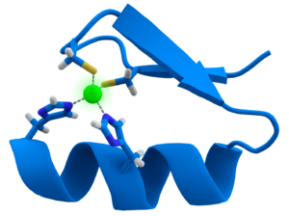
Les doigts de zinc sont de petits motifs structuraux composés d'une hélice α et de deux feuillets β capables de lier un ion zinc.