Structure quaternaire
Définition : Structure quaternaire
La structure quaternaire représente l'association de plusieurs chaînes polypeptidiques possédant chacune sa propre structure tertiaire. Chaque monomère est appelé sous-unité et l'agencement tridimensionnel des sous-unités est stabilisé le plus souvent par le biais d'interactions non covalentes.
On distingue plusieurs types de structures quaternaires. Si deux sous-unités identiques sont associées, on parle de structure homodimérique. Si les deux sous-unités sont différentes, on dira que la structure est hétérodimérique. Il existe des structures multimériques d'ordre supérieur: trimère, tétramère, etc.
Exemple :
Video d'une structure quaternaire
Fondamental : Relation structure-fonction
L'origine de l'oligomérisation est multiple et peut conférer à la structure quaternaire une fonction particulière:
Définition : Coopérativité
Plusieurs sous-unités peuvent s'associer et coopérer pour améliorer la fonction initiale de chaque sous-unité.
Exemple :
L'hémoglobine illustre parfaitement la notion de coopérativité. L'hémoglobine est constituée de 4 chaines polypeptidiques identiques deux à deux (en rouge et bleu sur l'image) et de 4 groupements « hèmes » (ion fer complexé à une porphyrine, en vert sur l'image). Sa fonction est de fixer le dioxygène. La fixation de la première molécule de dioxygène augmente l'affinité de liaison de la seconde molécule, la fixation de la seconde augmente l'affinité pour la troisième et ainsi de suite.

Définition : Combinaison de sous-unités
Plusieurs sous-unités doivent s'associer pour conférer à l'assemblage quaternaire une fonction particulière. C'est par exemple le cas des récepteurs couplés aux protéines G (RCPG).
Exemple :
Les RCPG sont des récepteurs trans-membranaires permettant de traduire les stimuli chimiques en stimuli électriques, on appelle cela la transduction du signal. Pour cela, le récepteur (en rouge sur l'image) adopte une conformation particulière, dite “active”, stabilisée par la présence du ligand. Le couplage entre le récepteur et la protéine G (elle même constituée de trois sous-unités en vert, bleu et jaune sur l'image) permet à cette dernière de s'activer. C'est cette association qui permet de libérer une des sous-unités de la protéine G et de déclencher la cascade biochimique intracellulaire.

Définition : Co-localisation de fonctions
On parlera de co-localisation de fonctions lors de la formation d'un complexe multiprotéique où chaque monomère porte une fonction distincte des autres. C'est par exemple le cas des complexes multienzymatiques pour lesquels la structure quaternaire du complexe améliore la vitesse du processus catalytique global en optimisant la diffusion d'un substrat d'une enzyme à l'autre.
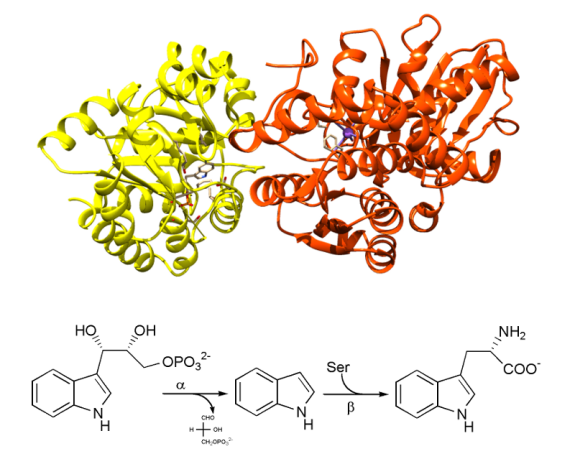
Exemple :
La tryptophane synthase est une enzyme bi-fonctionnelle, elle comporte deux sous-unités présentant chacune un site actif catalysant une réaction chimique. L'indole formé à partir d'indole-3-glycérol phosphate dans la sous-unité α (en jaune sur l'image) est condensé à la serine pour former le tryptophane dans la sous-unité β (en orange). Le complexe multienzymatique optimise la diffusion du substrat d'une sous-unité à l'autre par la création d'un tunnel hydrophobe entre les sites actifs.
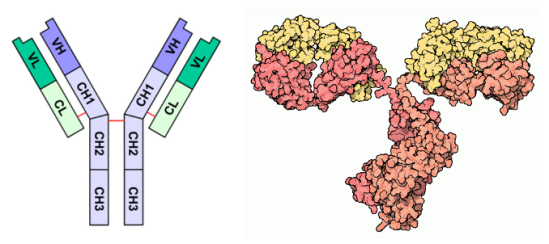
Définition : Assemblage structural
Plusieurs sous-unités doivent s'associer pour former un édifice complexe stable. Ce n'est que par assemblage structural que le complexe ainsi formé sera fonctionnel.
Exemple :
Les anticorps font partie de la famille des immunoglobulines et sont constitués de 4 chaînes polypeptidiques: 2 chaînes dites “lourdes” (notées H pour heavy en anglais sur l'image de gauche et représentées en rouge/orange sur l'image de droite) et 2 chaînes légères (notées L pour light en anglais sur l'image de gauche et représentées en jaune sur l'image de droite), chacune possédant une région variable (notée V) et une ou plusieurs régions constantes (notées C). Sa fonction est de se lier aux antigènes. Le site de reconnaissance se situe à l'extrémité des régions VL et VH.