C. La Liaison peptidique
Les acides aminés sont considérés comme des monomères qui réagissent chimiquement les uns avec les autres pour former des polymères. Ces polymères sont soit des protéines (~ plus de 50 acides aminés), soit des peptides (~ moins de 50 acides aminés).
Plus simplement, un composé formé de 2 acides aminés sera appelé dipeptide, avec 3 : un tripeptide, etc.
Définition :
La liaison peptidique est la liaison chimique qui résulte de la réaction entre le groupement acide d'un acide-aminé et le groupement amine d'un autre. La réaction entraîne la libération d'une molécule d'eau, comme indiqué dans le schéma suivant dans lequel la liaison peptidique est indiquée en bleu :
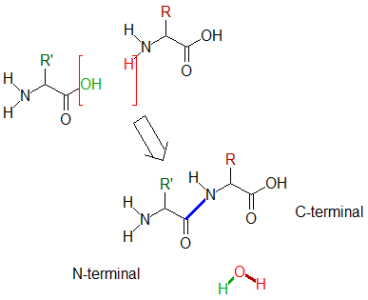
Exemple :
Le dipeptide dialanine est formé par la liaison entre 2 acides aminés de type alanine. Son code à une lettre est A-A, son code à trois lettres est Ala-Ala.
Le tetrapeptide ‘Tyr-Val-Ala-Ser' a pour code à une lettre ‘YVAS'.
Le sens de lecture de ces polymères biologique commence par l'acide aminé dont la partie aminée est intacte. On parle de ‘résidu N-terminal'. La fin de la séquence est un acide aminé dont la partie acide carboxylique est restée intacte, on parle de ‘résidu C-terminal'.
Exemple :
Le tetrapeptide ‘Tyr-Val-Ala-Ser' (YVAS) peut s'écrire N-Tyr-Val-Ala-C-Ser. Ici, on spécifie que le premier acide-aminé est la tyrosine et le dernier la sérine.





