D. Squelette peptidique
La liaison peptidique (entre les groupes NH et CO) est une liaison qui ne peux pas tourner sur elle-même en raison de la délocalisation électronique. Il en résulte que les seules possibilités de modification structurale se trouvent de part et d'autre de cette liaison. On peut ainsi caractériser la structure d'un peptide sur la base des deux angles dièdres (angle formé entres 4 atomes, cf lien web
Définition :
Définition :
L'angle dièdre φ (phi) entre deux résidus n et n+1 dans un peptide est défini par les quatre atomes (C)n-(N-α-C)n+1
Définition :
L'angle dièdre ψ (psi) entre deux résidus n et n+1 dans un peptide est défini par les quatre atomes (N-α-C)n-(N)n+1
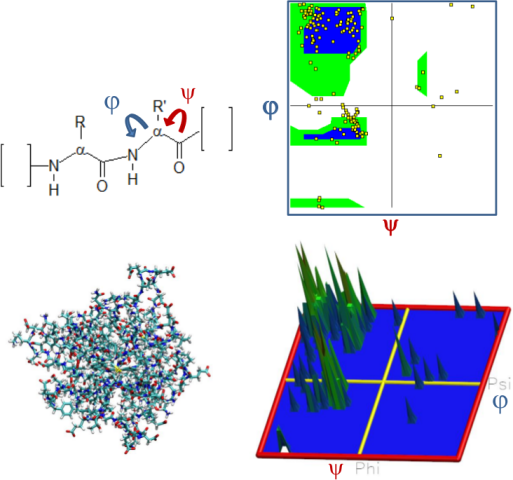
On trouvera donc une grande quantité d'angles φ et ψ pour définir la structure d'un peptide ou d'une protéine. On peut projeter l'ensemble de ces angles sur une carte. Ces angles ne peuvent pas prendre n'importe quelle valeur dans la mesure où ils sont contraints par les contacts atomiques entre groupes chimiques du peptide.
Il existe malgré tout des « ilots de stabilité » qui correspondent à des structures particulièrement stables. Ils ont été prédits par un chercheur du nom de Ramachandran. La carte est appelée carte de Ramachandran.
Exemple :
Dans l'image suivant, on représente une protéine constituée de 170 acides-aminés. L'ensemble des angles φ et ψ est calculée puis projetée sur la carte de Ramachandran. Une version 3D est aussi présentée, dans laquelle la hauteur du pic est proportionnelle au nombre d'acides aminés dans cette zone de la carte. On remarque que seules certaines zones de la carte sont peuplées. Ces zones correspondent aux ilots de stabilité de la conformation des acides-aminés. Les ilots sont schématisés en bleu et entourés de vert sur la carte.
Exemple :
Video tripeptides





